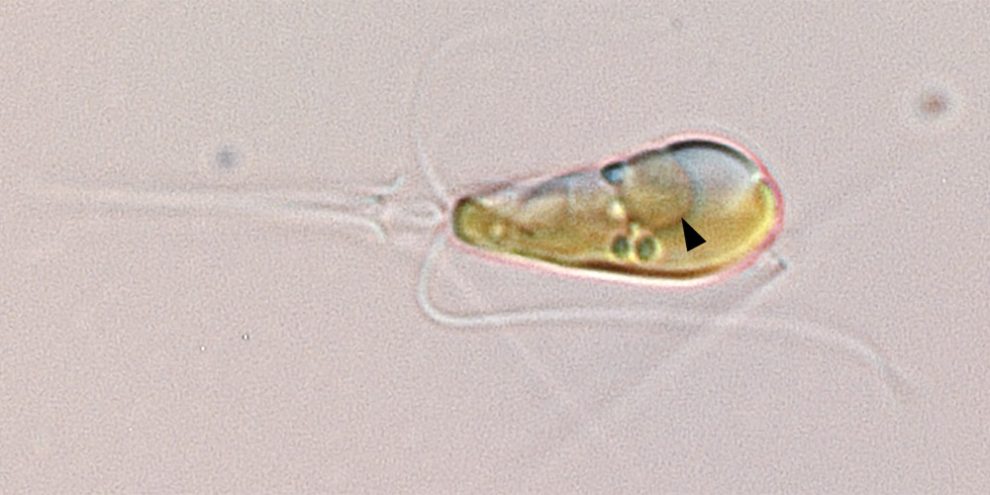
Von der Symbiose zum Organell: In einer Meeresalge ist ein bakterieller Symbiosepartner dabei, sich in ein neuartiges Zellorganell zu verwandeln. Dank dieses Nitroplasten kann die Alge nun Stickstoff aufnehmen und speichern – eine unter Eukaryoten bisher einmalige Fähigkeit, wie ein Forschungsteam in „Science“ berichtet. Die Entstehung des Nitroplasten ähnelt der von anderen Zellorganellen wie Mitochondrien und Chloroplasten. Eine solche Endosymbiose ist in der Evolution sehr selten.
Anders als Bakterien enthalten die eukaryotischen Zellen von Pflanzen und Tieren verschiedene Organellen. Diese zellulären Mini-Organe bilden spezialisierte Strukturen und können so spezifische biologische Funktionen erfüllen. Mitochondrien und Chlorplasten sind zum Beispiel für den Energiestoffwechsel beziehungsweise die Fotosynthese zuständig.
Einer gängigen Theorie zufolge sind diese Organellen im Zuge der Evolution entstanden, als eukaryotische Zellen Bakterien als Endosymbionten in ihr Inneres aufgenommen haben. Das ermöglicht eine effektivere Zusammenarbeit der verschiedenen Organismen und bietet einen Evolutionsvorteil.
Symbiose ermöglicht Stickstoffspeicherung
Zur Aufnahme und Verarbeitung von molekularem Stickstoff (N2) hat die Natur bislang jedoch keine spezialisierten Zellorganellen hervorgebracht. Um an diesen wertvollen Nährstoff zu gelangen, gehen viele Pflanzen stattdessen in ihren Wurzeln eine Symbiose mit verschiedenen prokaryotischen Mikroben ein, die den Stickstoff aus der Atmosphäre fixieren können, indem sie ihn in Ammonium umwandeln. Im Gegenzug profitieren die Mikroben vom Kohlenstoff-Stoffwechsel der Eukaryoten. Wie genau diese Zusammenarbeit funktioniert, ist jedoch kaum erforscht.
Um mehr darüber zu erfahren, hat ein Team um Tyler Coale von der University of California in Santa Cruz eine solche Symbiose genauer untersucht. Die Mikrobiologen analysierten, wie die einzellige Meeresalge Braarudosphaera bigelowii mit dem stickstofffixierenden Cyanobakterium Candidatus Atelocyanobacterium thalassa (UCYN-A) zusammenlebt. Aus früheren Studien ist bekannt, dass das Bakterium als Endosymbiont im Inneren der Alge lebt und mit ihr Nährstoffe austauscht. Coale und seine Kollegen untersuchten nun den dreidimensionalen Aufbau der einzelnen Zellbestandteile mithilfe von Röntgentomografie.
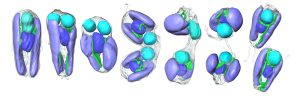
Organell-ähnliches Verhalten bei Zellteilung
Dabei zeigte sich überraschend: Wenn sich eine Algenzelle teilt, teilt sich gleichzeitig auch das darin befindliche Bakterium UCYN-A, so dass jede Tochterzelle wiederum mit einer solchen stickstofffixierenden Komponente ausgestattet ist. Dieser koordinierte Vorgang ähnelt der Aufteilung von Organellen während der Zellteilung von Eukaryoten, wie das Team berichtet.
„Wenn man sich Mitochondrien und Chloroplasten ansieht, ist es dasselbe: Sie wachsen mit der Zelle“, sagt Seniorautor Jonathan Zehr von der University of California. Das deutet darauf hin, dass auch das Bakterium UCYN-A sich ähnlich wie ein Organell in der Alge verhält und kein eigenständiger Organismus mehr ist. Denn für eine solche koordinierte Zellteilung müssen Alge und Bakterium sich eng abstimmen. Wie gelingt das?
Genetische Abhängigkeit von der Wirtszelle
Detaillierte Folgeanalysen ergaben, dass UCYN-A hunderte Proteine enthält, die nicht im Erbgut des Bakteriums, sondern im Erbgut der Alge im Zellkern kodiert sind. UCYN-A importiert demnach Proteine von der eukaryotischen Wirtszelle, der Alge. Darunter sind auch solche Proteine, die die Zellteilung regulieren, wie Coale und seine Kollegen berichten.
„Das ist eines der Kennzeichen dafür, dass sich eine Mikrobe von einem Endosymbionten zu einem Organell entwickelt“, sagt Zehr. „Das Bakterium fängt an, DNA-Stücke wegzuwerfen, sodass sein Genom immer kleiner wird.“ Es wird dadurch von der Mutterzelle und ihren Genprodukten abhängig.
Organell in frühem Evolutionsstadium
Die Ergebnisse legen nahe, dass UCYN-A für die Alge nicht länger ein eigenständiger Endosymbiont ist, sondern sich schon zu einem stickstofffixierenden Organell im frühen Evolutionsstadium entwickelt hat. Es ist das erste Mal, dass der Vorläufer eines solchen Organells in der Natur beobachtet wurde. Die Biologen tauften diese neu entstehende Zellstruktur Nitroplast. Damit gehe die Entdeckung in die Lehrbücher ein, so das Team.
Die Evolution des Nitroplasten ist noch im Gange. Begonnen habe sie vor etwa 100 Million Jahren und damit deutlich später als die Evolution von Mitochondrien und Chloroplasten vor Milliarden Jahren, wie Coale und seine Kollegen berichten. „Der Nitroplast stellt einen Lehrbuchfall für ein eukaryotisches Organell dar, das den Energie-, Kohlenstoff- und Stickstoffbedarf des Algenwirts ergänzt“, schreibt Ramon Massana vom Institut für Meereswissenschaften (CSIC) in Barcelona in einem begleitenden Kommentar zur Studie.
Relevanz auch für die Landwirtschaft
Die chemische Reaktion, mit der das Bakterium beziehungsweise der Nitroplast Stickstoff in Ammonium umwandeln, kann auch industriell durchgeführt werden – mit dem sogenannten Haber-Bosch-Verfahren. Darüber werden im großen Stil Düngemittel für die Landwirtschaft hergestellt, damit die Nutzpflanzen mehr Stickstoff zur Verfügung haben und schneller wachsen.
Statt dieses aufwendigen Prozesses könnten in der Landwirtschaft künftig möglicherweise Nitroplasten verwendet werden. „Dieses System bietet eine neue Perspektive auf die Stickstofffixierung und könnte Hinweise darauf liefern, wie ein solches Organell in Nutzpflanzen eingebaut werden könnte“, sagt Coale. Dafür müssen jedoch Folgestudien zunächst genauer klären, wie die Meeresalgen und UCYN-A interagieren. (Science, 2024; doi: 10.1126/science.adk1075)
Quelle: American Association for the Advancement of Science (AAAS), University of California – Santa Cruz